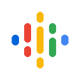
Небольшие количества паклитаксела (Таксол ® ) были выделены из твердой скорлупы, зеленых оболочек и листьев фундука Томбул ( Corylus arellana L.). Помимо паклитаксела в экстрактах обнаружены 10-деацетилбаккатин III, баккатин III и цефаломаннин. Таксаны не были обнаружены в ядрах и скорлупе орехов этого сорта. Присутствующие количества варьировались от 8,61 до 68,22 микрограммов на грамм образца в обезжиренном и высушенном виде. Хотя возможно, что эти таксаны производятся грибами, связанными с фундуком, вполне вероятно, что они производятся тканями растения.
1 . Введение
Многие растения рода Taxus (тис) производят комплекс дитерпеноидов паклитаксел, противораковый ингредиент Таксола ® , который продается компанией Bristol Myers Squibb и одобрен Управлением по контролю за продуктами и лекарствами США для лечения заболеваний яичников, молочной железы и рак легких, а также саркома Капоши, связанная со СПИДом ( Waniet al., 1971 , Baloglu and Kingston, 1999a ). Эта молекула повышает стабильность микротрубочек в клетке и индуцирует апоптоз ( Horwitz et al., 1993 , Wang et al., 1999 ). Паклитаксел принадлежит к более широкому классу дитерпеноидов, известных как «таксаны» ( рис. 1 ). Эти соединения известны как «вторичные метаболиты», поскольку они не необходимы для роста растения, но помогают в его защите от окружающей среды и других внешних факторов. Возможная роль паклитаксела у тиса может заключаться в защите от патогенов ( Stierle et al., 1995 ).
2 . Материалы и методы
2.1 . Продукты из фундука и их добыча
Фундук Томбул ( Corylus arellana L.) был произведен в Гиресуне, Турция, а побочные продукты, а именно коричневая твердая скорлупа, зеленая оболочка скорлупы и листья, были измельчены до размера менее 100 мкм, а затем обезжирены гексаном. Неочищенные экстракты фенольных соединений готовили экстракцией 80% водным этанолом (1:10, мас./об.) при 4 °С в течение 16 часов. Полученные суспензии центрифугировали при 4000 g в течение 5 мин и собирали надосадочную жидкость. Остатки повторно экстрагировали аналогичным образом и экстракты объединяли. Затем растворитель удаляли в ротационном испарителе при 40 °С и концентрированные суспензии лиофилизовали при -47 °С в течение 72 часов.
2.2 . Хранение и обработка образцов
Экстракты проб растворяли в метаноле и небольшом количестве воды (5–10%). Метанол выпаривали и водную смесь выливали на колонку с пипеткой С-18 для удаления избытка солей натрия. Образец промывали из колонки С-18 метанолом. Растворитель выпаривали и образец повторно растворяли в метаноле до концентрации 200 г/л. Между анализами образцы хранили при -20 °С в морозильной камере в высушенном виде.
2.3 . Условия хроматографии ЖХ-МС
Разделение проводили с использованием колонки для ВЭЖХ Restek Allure C18, 5 мкм, 100 × 3,2 мм (Bellefonte, PA). Градиентные условия: 100% подвижной фазы A (удерживается в течение 1 минуты) и увеличивается до 100% подвижной фазы B в течение 20- минутного периода и выдерживается в течение 5 минут. Подвижная фаза А: (вода:1 мМ ацетат аммония:0,1% уксусная кислота:1% метанол (1:1:1:1, об/об/об/об)); подвижная фаза B (99% метанол в воде:1 мМ ацетат аммония:0,1% уксусная кислота (1:1:1, по объему/объему)). Скорость потока растворителя: 4,5 мкл/мин, объем впрыска — 0,5 мкл.
2.4 . Масс-спектрометрия с электрораспылением/ионной ловушкой
Для обнаружения таксанов в реальном времени при массовом соотношении 50–2000 использовали прибор ThermoQuest Finnegan LCQ TM (Сан-Хосе, Калифорния), оснащенный источником ионов электрораспылением (ES), и он работал в режиме положительных ионов. Игла ES работала при напряжении примерно 4,5–5,2 кВ. Напряжение распыления составляло 4,82 кВ и использовался ток 2,10 мкА.
2.5 . Идентификация таксанов
Молекулярные и другие ионы в экстрактах сравнивались с аутентичными стандартами (Hauser, Boulder, CO) и с таблицами, представленными в исследовании Kerns et al. (1994) .
2.6 . Жидкостная хроматография
Разделение для количественного определения таксанов проводили с использованием бинарной системы доставки растворителя Dynamax и детектора поглощения УФ-1 (Rainin/Varian, Emeryville, CA) при длине волны 228 нм с колонкой Curosil B с обращенной фазой (Phenomenex, Torrance, CA) и скорости потока 1,0 мл/мин с 45% ацетонитриловым и 55% аммонийно-ацетатным буфером (1 мМ, pH 4) в изократических условиях. Контролировали шесть таксанов: 10-деацетилбаккатин III (4,8–4,9 мин), баккатин III (6,7–6,8 мин), 10-деацетилтаксол (11,4–11,6 мин), цефаломаннин (14,7–15,0 мин), 7-эпи-10. -деацетилтаксол (16,5–16,7 мин) и паклитаксел (17,5–17,8 мин). Десять микролитров каждого образца вводили как минимум дважды без стандартов, чтобы убедиться, что данные репрезентативны для образца, а затем один раз вводили стандарты.
Колонку калибровали по нескольким концентрациям каждого из шести аутентичных стандартов таксанов, и площади пиков могли использоваться для оценки количества таксанов в экстрактах. Расчеты проводились в электронной таблице Excel.
3 . Результаты и обсуждение
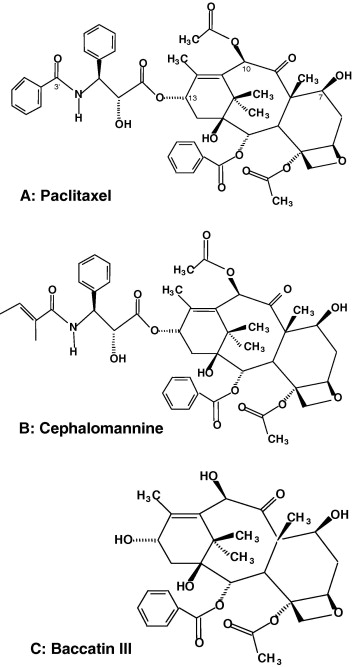
Экстракты муки из зрелых орехов, коричневой твердой скорлупы, зеленой оболочки скорлупы и листьев анализировали с помощью ВЭЖХ на калиброванной колонке с обращенной фазой, используя условия, описанные в разделе 2 . Соответствие времени удерживания было обнаружено для нескольких таксанов в экстрактах листьев, зеленой оболочки скорлупы и коричневой твердой скорлупы. Две репрезентативные хроматограммы ВЭЖХ на рис. 2 показывают относительное время удерживания таксанов.
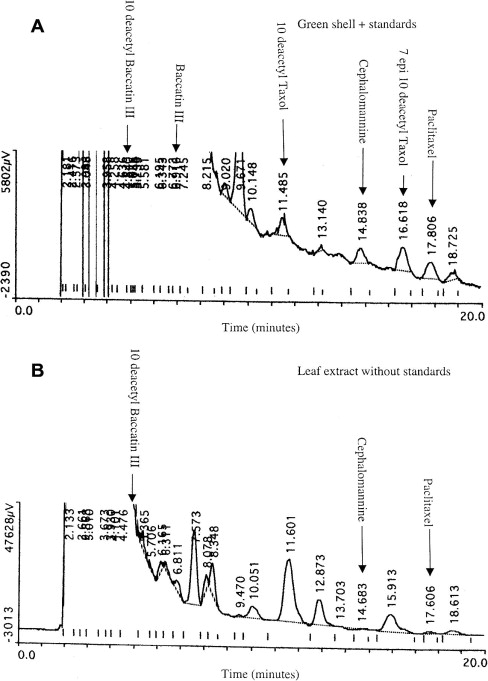
Данные ВЭЖХ проверяли с помощью LC/MS. На рис. 3 показаны репрезентативные масс-спектры паклитаксела и цефаломаннина из экстракта листьев. Они подтверждают, что эти таксаны присутствовали в экстракте и что паклитаксел присутствовал в более высокой концентрации, чем цефаломаннин. Звездочки на спектрах указывают массы, которые были наиболее полезны для идентификации соединений ( Kerns et al., 1994 ).
В таблице 1 приведены количества таксанов, определенные количественно по пикам ВЭЖХ, которые были подтверждены данными ЖХ/МС. Концентрации этих таксанов, по-видимому, низкие и могут составлять примерно десятую часть от таковых в тисе тихоокеанском. Экстракты коричневой скорлупы и листьев содержали 10-деацетилбаккатин III, цефаломаннин и паклитаксел, но экстракт зеленой скорлупы содержал только баккатин III. Хотя ничего не обнаружено, вполне возможно, что таксаны могут присутствовать в ядре фундука. Паклитаксел и многие другие таксаны лучше растворяются в масле фундука, чем в растворителях, используемых для их экстракции. Таксаны могли быть удалены вместе с нефтью при первоначальной экстракции.
Таблица 1 . Содержание таксанов (микрограммы на грамм обезжиренной и высушенной исходной пробы) листьев, коричневой твердой скорлупы и зеленой покровной скорлупы фундука
| Образец | 10 дней БIII | БIII | 10дТ | Цеф | 7,10дТ | Паклитаксел |
|---|---|---|---|---|---|---|
| Лист | 7,71–1,48 | без даты | без даты | 0,16–0,01 | без даты | 0,74–0,08 |
| Коричневая оболочка | 22.52–3.53 | без даты | без даты | 43,80–8,36 | без даты | 1,90–0,13 |
| Зеленая ракушка | без даты | 67,77–1,10 | без даты | без даты | без даты | без даты |
Выходы экстрактов из обезжиренных образцов составили 1,64–0,11% по экстракту листьев. 2,53–0,28 % для экстракта коричневой скорлупы и 3,59–0,70 % для экстракта зеленой скорлупы.
Сокращения следующие : 10d BIII, 10-деацетилбаккатин III; BIII, баккатин III; 10дТ, 10-деацетилтаксол; Цеф, цефаломаннин; 7,10дТ, 7-эпи-10-деацетил таксол и НД не обнаружены. Концентрация образца составляла 200 г/л, вводили 10 мл.
Таксаны, обнаруженные в исследованных экстрактах тканей фундука, по существу находятся в том же соотношении, что и в некоторых видах тиса ( Kelsey and Vance, 1992 , Witherup et al., 1990 ). Это позволяет предположить, что механизм накопления таксанов у этих двух организмов может быть сходным. Однако общее содержание таксанов в обезжиренных продуктах из побочных продуктов из фундука, по-видимому, составляет лишь небольшую часть от такового в тисе тихоокеанском, который обычно составляет 0,004–0,1% в пересчете на сухой вес. Тем не менее, деревья фундука растут намного быстрее, чем тис тихоокеанский. Таким образом, побочные продукты переработки фундука могут служить легкодоступным возобновляемым источником таксанов и альтернативой натуральной коре тиса.